Kimyasal sembolü C olan karbonun atom numarası 6’dır. Gezegenin 4,5 milyar yıl önce oluşmasından bu yana Dünya’da var olan karbon, tarih öncesi çağlardan bugüne kadar tüm teknolojik gelişmelerin merkezinde yer almıştır. Karbon kelimesi, kömür anlamına gelen Latince ‘carbo’ kelimesinden gelmektedir. İlk olarak Mısırlılar ve Sümerler (M.Ö. 3750) tarafından keşfedilmiştir, ancak bir element olarak ilk kez Antoine Lavoisier (1789) tarafından tanınmıştır. Karbon, diğer karbon atomları ile etkileşime girebilir ve allotroplar oluşturabilir. Ayrıca bileşikler oluşturmak için farklı elementlerin atomları veya atom grupları ile etkileşime girebilir. Karbon içeren bileşikler organik veya inorganik olarak sınıflandırılabilir. O kadar çok bileşik oluşturabilir ki elementlerin kralı olarak anılır.
Kararlı bir karbon atomu altı protona, altı nötrona ve altı elektrona sahiptir, bu da 12.011’lik bir atomik kütle ile sonuçlanır. Periyodik tablonun ikinci periyodunda, 14. grubunda yer alan bir ametal olan karbonun elektronlarının dördü atomun dış kabuğunda (değerlik kabuğunda), diğer ikisi ise iç kabuğunda bulunur. Değerlik kabuğunda 4 elektron bulunduğundan değerliliği 4’tür yani tetravalenttir. Oktetini tamamlamak için 4 elektrona daha ihtiyacı vardır. Dolayısıyla, karbon diğer atomlarla 4 kovalent bağ yapar.
Not: Oktet kimyasal bağ kuralı, elementlerin birbirleriyle, hepsinin değerlik kabuğunda 8 elektron olacak şekilde bağ yapmaya çalıştıklarını belirtir. Değerlik kabuğunda 8 elektrona sahip olmak, kararlı bir elektronik konfigürasyon olarak kabul edilir.
Karbonun Biyolojik Önemi
Karbon, Dünya’da en bol bulunan kimyasal elementlerden biridir. Karbon, evrende en yaygın dördüncü element ve yer kabuğunda en yaygın 17. elementtir. Dünya üzerindeki yaşam, varlığını karbona borçludur, çünkü bu gezegendeki tüm canlıların kimyasal temelini oluşturur, canlı bir organizmadaki hemen hemen her molekül karbon içerir. İnsan vücudunda oksijenden sonra kütlece en çok bulunan ikinci element olan karbon, yetişkin insan vücudunun yaklaşık %18,5’ini oluşturur. Dört değerlik elektronu nedeniyle karbon molekülleri oksijen, hidrojen ve nitrojen ile bağ kurar. Karbon ayrıca fosfor ve sülfür ile de bağ kurarak yağlar, proteinler ve karbonhidratları içeren biyokimyasal yapı taşlarını oluşturur. Yaşam için kesinlikle gerekli olmasının yanı sıra karbonun canlı organizmalar üzerinde birkaç kötü etkileri de vardır. Örneğin kara akciğer, kömür madencilerinde gelişen bir hastalıktır. Madencinin akciğeri, madenci tarafından kömür tozu solunduğunda ortaya çıkan siyah bir renk alır. Bu kömür tozu, oksijenin akciğerlere girdiği küçük delikleri tıkar ve bu da en kötü durumda ölümle sonuçlanabilecek nefes alma zorluğuna neden olur
Karbon İçeren Maddeler
Karbon polimorfik (doğada çeşitli şekillerde bulunan) bir elementtir. Karbon, magnezyum (MgCO3) ve kalsiyum karbonat (CaCO3) gibi minerallerde bulunur, nadiren grafit ve elmas olarak bulunur. Havanın bir bileşeni olan karbondioksit de karbon içerir. Karbondioksit atmosferin çok küçük bir bölümünü oluşturmasına rağmen fotosentez için kullanıldığı için çok önemli bir gazdır. Birkaç çeşit kömür neredeyse saf karbondur. Petrol ve doğal gaz, hidrojenle birleşmiş hidrokarbonlar formunda karbon içerir.
Karbon Allotropları
Bazı elementler, temel kimyasal özelliklerini değiştirmeden iki veya daha fazla farklı forma sahip olabilir. Aynı elementin bu farklı biçimlerine allotrop denir. Örneğin, oksijenin 3 allotropu vardır. Bunlar O2 (nefesle alınan oksijen gazı), O3 (Ozon gazı) ve O4 veya tetra oksijendir. Benzer şekilde, karbonun da çok sayıda allotropu vardır. Karbon, kovalent bağlarla bağlanmış atomlarla kararlı uzun zincirli moleküller oluşturma yeteneğine sahiptir. Bu yetenek, karbon’un çok fazla allotropa sahip olmasına izin verir. Kovalent Bağ, elementler elektron çiftlerini birbirleriyle paylaştığında oluşan kimyasal bir bağdır. Bazen belirli elementlerin atomları bir araya gelerek milyonlarca atomdan oluşan dev bir molekül oluşturur. Bu moleküllere dev kovalent yapılar denir. Elmas, grafit ve grafen, farklı dev kovalent yapılara sahip karbon formlarıdır. Sadece tek bir element türünden, yani karbondan oluşmalarına rağmen karbon allotropları fiziksel özellikleri bakımından farklılık gösterirler. Örneğin, grafit opak ve siyahken, elmas şeffaftır. Grafit yumuşaktır, elmas ise doğal olarak oluşan en sert madde olarak kabul edilir. Grafit iyi bir elektrik iletkeni iken elmas elektriği iletmez. Allotroplar bileşik değil saf elementlerdir. Karbon allotroplarının iki kategorisi vardır:
1-Kristal karbonlar
2-Amorf karbonlar
Kristal Karbonlar
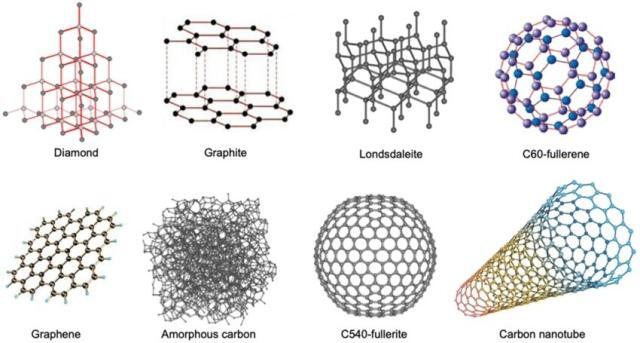
Kristal, atomların bazı temel yapıların tekrarlanan bir düzeninde düzenlendiği bir katıdır. Kristal yapıya sahip bir malzemenin kristal olduğu söylenir. Karbonun kristalli allotroplarının örnekleri, Elmas, Grafit ve Fulleren’dir.
Elmas
Elmas ya da diğer adıyla mücevherde kullanılan pırlanta tamamen karbon atomlarından oluşur. Takı (mücevher) yapımında göz alıcı parlaklık için yaygın olarak kullanılan en değerli karbon allotropudur. Bilim insanları, dünya’nın merkezi ile yer kabuğu arasındaki yoğun ısı ve basınç nedeniyle, dünya’nın iç kısmının yaklaşık 140 ila 190 km altında elmasların oluşmasının yaklaşık 1 ila 3 milyar yıl sürdüğünü düşünmektedir. Bu karbon allotropları genellikle renksizdir.

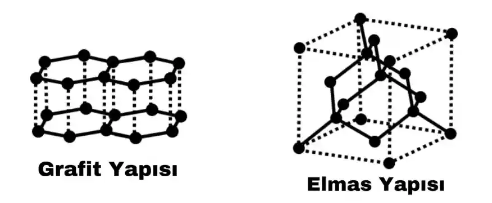
Elmas, tetrahedral (dörtyüzlü) yapıya sahiptir. Her Karbon atomunun 4 kovalent bağı vardır. Elmas, karbon atomlarının tetrahedronlarının tekrarlarından oluştuğu için kristal bir yapı oluşturur. Elmasın yapısı çok kararlıdır ve atomlar, aralarında güçlü kovalent bağlarla sıkı bir şekilde paketlenmiştir. Bu nedenle hiçbir madde ile reaksiyona girmezler ve inerttirler. Elmaslar parlak bir görünüm veren yüksek kırılma indisine sahip çok saf, neredeyse renksiz bir kristal yapıdadır, ışık içinden geçerken oldukça fazla ışıltı verirler. Elmasta atomların dizildiği moleküler yapı ve güçlü kovalent bağların varlığı, elması dünyanın en sert malzemesi yapar. Başka bir doğal madde elması çizemez. Aşırı sertlikleri nedeniyle elmaslar cam kesmek, taş kesmek, taşları delmek, parlatmak ya da cilalamak için kullanılır. Camı ve diğer katı cisimleri kesmek için kullanılan opak elmasa bort denir. Taşları kesmek ve cilalamak için kullanılan siyah elmaslara da karbonado denir.
Elmas, iyi termal iletkenliğe ve zayıf elektrik iletkenliğine sahiptir. Elmas elektriği iletmez çünkü elektrik akımını taşımak için yapı boyunca hareket edebilen serbest delokalize elektronlar veya iyonlar yoktur. Elmas, düşük kimyasal reaktiviteye ve çok yüksek bir erime noktasına (neredeyse 4000 santigrat derece) sahiptir. Ayrıca, son derece yanıcıdır. Nadir bulunması, düşük kimyasal reaktivitesi (dolayısıyla yüksek biyolojik uyumluluğu) ve tabii ki güzelliği onu kuyumculuk endüstrisinde değerli bir malzeme yapar. Yüksek bağıl yoğunluğa sahip olması, suda ve organik çözücülerde çözünmemesi, kristal yapısından dolayı ultraviyoleden kızılötesine kadar değişen ışınların geçmesine izin vermesi elmasın diğer özellikleri arasındadır.
Dünyadaki elmasların yaklaşık %95’i Güney Afrika’da bulunur. Bunun yanı sıra Avustralya, Brezilya, Amerika ve Hindistan’da da bulunurlar. Sentetik endüstriyel elmaslar üretmek mümkündür, ancak doğal olarak oluşan elmaslar kadar mükemmel veya değerli olmasalar da, kesici aletlerde kullanım için aynı derecede kullanışlı ve ucuzdurlar.
Grafit
Grafit, karbonun başka bir kristal allotropudur. Karbonun saf bir formudur, dev bir kovalent yapıya sahiptir. Elmas gibi, yerkabuğunun altında bulunan yüksek sıcaklık ve basınç koşullarında doğal olarak oluşur. Kristalleri altıgen şeklindedir. Grafit, granit, gnays, mika ve kristal kireçtaşı çatlaklarında büyük topaklar halinde veya lifli tabakalara dağılmış olarak bulunur. Grafit, elmastan farklı olarak koyu gri, neredeyse siyah ve opak olmasına rağmen, biraz parlak ve pürüzsüz görünür. Grafit elmastan daha düşük bir yoğunluğa sahiptir. Elmasın yoğunluğu 3,51 g/cm³ arasında, grafitin yoğunluğu ise 2,25 g/cm³ arasında dalgalanır.
Grafitin yapısı çok ilginçtir. Grafitte, her karbon atomu diğer 3 karbon atomuyla 3 tekli kovalent bağ yapar. Atomlar, birleştirilmiş altıgen halkalardan oluşan düz, iki boyutlu, 1 atom kalınlığında bir tabaka oluşturur. Her halkada 6 karbon atomu vardır ve üst üste yığılmış bu tür çok sayıda katman grafitin yapısını oluşturur. Grafit formundaki karbon, önemli bir elektrik iletkeni olan tek ametaldir. Her karbon atomu yalnızca 3 kovalent bağ yaptığından, serbest bir eşlenmemiş elektrona sahiptir. Bu eşleştirilmemiş elektron (delokalize elektron) grafit yapısında yer değiştirir, yani herhangi bir belirli atomla ilişkili değildir ve tüm yapı içinde serbestçe hareket edebilir. Bu delokalize elektronlar grafiti elektriksel ve termal olarak iletken hale getirir. Elektrik iletkenliğine sahip olması grafiti pillerdeki elektrotlar ve elektroliz için kullanışlı hale getirir. Grafit, elektrik reaktörlerinin elektrotları olarak, ayrıca grafit çubuklar nükleer reaktörlerde kullanılır.
Grafitte katmanlar arasında zayıf moleküller arası kuvvetler vardır. Bu özellik, katmanların birbiri üzerinde kaymasına izin verir, bu nedenle grafit yumuşak ve pürüzsüzdür, doğal olarak bulunan tek katı hal yağlayıcıdır. Grafit, yüksek sıcaklıklarda çalışan ve yağ ile yağlanamayan makinelerde kuru yağlayıcı olarak kullanılabilir. Grafit kendi başına bir yağlayıcı olarak kullanılsa da performanslarını artırmak için bazen diğer yağ bazlı yağlayıcılara eklenen önemli bir katkı maddesidir. Yumuşak, kaygan bir yapıya sahip olması nedeniyle kurşun kalemlerde kullanılır. Yazarken kurşun kalemin ucu kağıt üzerine sürtüldüğünde, basınç uygulandığında grafit katmanları kağıt üzerinde kolayca kayar. Yumuşak olduğu için kağıda sürtünerek iz bırakır. Grafitin yumuşaklığı aynı zamanda onun kolayca yontulmasını ya da sivriltilmesini sağlar. Grafit, elmasınkine benzer şekilde yüksek bir erime noktasına (3500 santigrat derece) sahiptir. Tahmini kaynama noktası ise 4830 santigrat derecedir. Grafiti eritmek için bir tabakayı diğerinden ayırmak yeterli değildir. Tüm yapı boyunca kovalent bağın kırılması gerekir.
Grafit mineral olarak Sri Lanka, Sibirya, Meksika, İtalya, Kanada, ABD’de Kaliforniya ve Hindistan’da Sikkim eyaletinde bulunur. Yapay grafit, kum, kok tozu ve ferrik oksit (demir oksit) karışımının 3000°C sıcaklıkta 24 ila 30 saat ısıtılmasıyla elde edilir.

Grafen
Grafen, kristal karbon allotropunun başka bir örneğidir. Tek bir grafit tabakasına grafen denir. Grafen, nanotüplerin, odun kömürünün ve fullerenlerin de temel yapısal bileşenidir. Grafen iki boyutlu bir nanomalzemedir çünkü her katman, çok sayıda bağlı altıgen karbon atomu halkasından oluşur ve yalnızca bir karbon atomu kalınlığındadır, ışığa karşı şeffaftır. Karbon atomları arasındaki güçlü kovalent bağlar, bu özelliği grafenin çok yüksek bir erime noktasına sahip olduğu ve çok güçlü olduğu anlamına gelir. Grafit gibi, grafen de delokalize elektronlar ( yüzeyinde serbestçe hareket edebilen elektronlar) nedeniyle yüksek termal iletkenliğe ve yüksek elektrik iletkenliğine sahiptir. Grafen aslında bakırdan daha iyi bir termal enerji (ısı) iletkenidir. Grafen ayrıca yüksek elastikiyet ve esnekliğe sahiptir. Güçlü karbon-karbon bağı nedeniyle, çelikten daha yüksek çekme mukavemetine sahip çok güçlü hafif bir malzemedir. Sahip olduğu özellikler, grafeni elektronikte ve kompozit yapımında kullanışlı kılmaktadır.
Fullerenler
Fullerenler, kristal karbon allotroplarıdır. İlk olarak 1985 yılında Amerikalı bilim insanları Robert F. Curl, Richard E. Smalley ve İngiliz bilim insanı Harold W. Kroto tarafından keşfedilmiş, kurum (is) ve göktaşlarında bulunmuştur. Fullerenler karbon atomlarından oluşan içi boş küreler, elipsoidler veya tüpler şeklini alan, tamamen karbondan oluşan çeşitli boyutlardaki moleküllerdir. Fullerenler kovalent bağlarla birleştirilmiş karbon atomlarından oluşan hekzagonal (altıgen) halkalara sahiptir. Bazı fullerenler pentagonal (beşgen) beş veya heptagonal (yedigen) karbon atomlu halkalar içerir. Bu karbon allotropları grafitin lazerle buharlaştırılmasıyla sentezlenebilir. Fullerenler grafite kıyasla zayıf bir elektrik iletkenidir. Bunun nedeni, elektronların moleküller arasında değil, bir fulleren molekülü içinde hareket edebilmesidir.
Yüksek sıcaklıklarda (1000°C’den fazla) fullerenlerin moleküler yapısı bozulur. Fullerenler, karbon disülfit, benzen, toluen, vb. gibi çeşitli organik çözücülerde çözünür. Fullerenlerin yoğunluğu 1.65gm / cmᶾ’dir, vücuttaki belirli bakterileri hedeflemek için yağlayıcılar, katalizörler ve hatta farmasötiklerde (genleri taşımada ve ilaç dağıtım sistemlerinde) kullanılabilir.
Fullerenlerin birkaç farklı biçimi vardır. Bunlar C60 (Buckminsterfulleren), C70 fulleren, C540 fulleren ve karbon nanotüplerdir.
C60 Fulleren (Buckminsterfulleren)
Keşfedilen ilk nanopartikül olan fulleren molekülü C60 olarak da adlandırılan Buckminsterfulleren’dir. Buckminsterfulleren, içi boş, futbol topunu andıran bir küre şeklinde düzenlenmiş, güçlü kovalent bağlarla birleştirilmiş 60 karbon atomundan oluşan bir moleküldür. Bu nedenle formülü C60’dır. Moleküler yapısı jeodezik bir kubbeninkine benzer. Jeodezik Kubbe, bir mimari şaheserdir. Tasarımcısı ve patentini alan kişi ünlü Amerikalı mimar Buckminster Fuller’dir. Bu nedenle C60, BuckminsterFulleren olarak adlandırılır. C60’ın diğer adı Buckyball’dur. C60 fullerenler koyu kahverengi kristalimsi katı maddelerdir.
Buckminsterfullerenlerde her karbon atomu diğer üçüne tekli kovalent bağlarla bağlıdır. Buckminsterfullerenlerin ya da Bucky toplarının yapısında 20 adet hekzagonal (altıgen) yüzlü halka ve 12 adet pentagonal ( beşgen) yüzlü halka bulunmaktadır. Buckminsterfullerenlerin çapları 1 nanometredir. 1 nanometre, 1 milimetrenin milyonda biri kadardır. Örneğin, bir insanın tırnağı 1 saniyede 1 nanometre kadar uzar. Buckminsterfulleren molekülleri arasında zayıf moleküller arası kuvvetler vardır. Bunların üstesinden gelmek için çok az enerji gerekir, bu nedenle buckminsterfulleren kaygandır ve düşük bir erime noktasına sahiptir.
C70 Fulleren
Formülü C70 olan, 70 karbon atomundan oluşan bir fulleren türüdür. Yapısı, bir rugby topuna çok benzer, rengi gri-siyahtır. Yapısı C60 fullerene çok benzer. 25 adet altıgen ve 12 adet beşgenden yapılmıştır. Erime noktası düşüktür, yoğunluğu 1,7 gm/cm3’dür. Bu karbon allotropları suda çözünmez.
C540 Fulleren
Saf karbonun yeni bir formu olan dev fulleren C540, içi boş sferoidal (küresel) şekillidir. C540 fullerenler nanoteknoloji kullanılarak oluşturulmuştur. İlk olarak 1990 yılında Huffman ve arkadaşları tarafından tanımlanmıştır. C540 fullerenler yıldızlararası gaz bulutlarında doğal olarak bulunur. Naftalin argon gazı içinde yüksek sıcaklıklarda (1000°C) ısıtıldığında fullerenleri verir. Fullerenler, Avustralya, Rusya, ABD, Kanada ve Yeni Zelanda’daki kömür madenlerindeki antrasit kömüründe bulunmuştur. Kanser tedavisi ve araştırmalarında kullanımı için çok fazla potansiyeli vardır. Fulleren bazlı teknoloji elektronik, itici güç ve mühendislik uygulamalarının yanı sıra ultra sert metal alaşımları ve ısıya dayanıklı silah sistemlerinin yapımında da kullanılmaktadır.
Diğer dev fullerenler arasında C240 ve C960 bulunmaktadır.

Karbon Nanotüpler
Karbon nanotüpler (CNT’ler) bir başka ilginç ve nispeten daha yeni bir fulleren molekülü grubudur. Bu karbon allotropları küresel fullerenlerin ( Bucky toplarının) silindirik yapıda olanlarıdır (silindir haline getirilmiş bir grafen tabakası gibidir), bu nedenle bucky tüpleri de denir. Bir nanotüpün uzunluğu, genişliğine kıyasla çok uzundur, bu nedenle nanotüplerin uzunluk/çap oranları yüksektir. Karbon nanotüpler yüksek çekme mukavemetine sahiptir, bu nedenle gerilmeye karşı direnç gösterirler yani kırılmadan gerilebilirler. Ayrıca grafit gibi delokalize elektronlar nedeniyle ısı ve elektrik iletkenidirler. Bu özellikler nanotüpleri nanoteknoloji, elektronik ve özel malzemeler için kullanışlı hale getirir.
Çok küçük içi boş tüpler olan karbon nanotüpler tek duvarlı nanotüpler ve çok duvarlı nanotüpler olmak üzere iki tiptir. Çok duvarlı karbon nanotüpler grafen tabakaların birkaç katman kalınlığında olacak şekilde yuvarlanmasıyla yapılan tüplerdir. Tek duvarlı bir karbon nanotüp içi boş ve silindir şeklindedir. Bunlar, fulleren ve grafen arasında kesişen karbon allotroplarından biridir. Tek duvarlı karbon nanotüp Bucky tüpü olarak adlandırılır. Çok yüksek elektriksel iletkenliğe sahiptirler. Tek duvarlı karbon nanotüpler düşük yoğunluğa sahiptir, çapı 1 nm’dir.
Yukarıda açıklanan nano materyallere ek olarak, yeni keşfedilen karbon allotropları arasında olan, manyetik özellikte, kristal yapılı, gözenekli karbon nano köpükler de bulunmaktadır. Karbon nanoköpük, birbirine gevşek bir şekilde bağlanmış birkaç karbon dalından oluşan üç boyutlu bir yapıdır. Ayrıca karbon nano tomurcukların varlığı da bilinmektedir. Karbon nano tomurcuklar, fulleren benzeri “tomurcukların” bir karbon nanotüpün dış yan duvarlarına kovalent olarak bağlandığı yeni keşfedilen allotroplardır. Nano tomurcuklar hem nanotüplerin hem de fullerenlerin özelliklerini sergiler.
Diğer Karbon Allotropları
Mevcut çalışmalar, yukarıda özellikleri belirtilen karbon allotroplarının dışında Lineer asetilenik karbon (kabrin) ve lonsdaleit (altıgen elmas) adlı allotroplar da olduğunu ortaya çıkarmıştır.
Lineer Asetilenik Karbon
Lineer asetilenik karbon (LAC) adlı alotrop değişen tekli ve üçlü bağlarla tekrar eden birimlere sahip bir karbon polimeridir. Lineer (doğrusal) karbon zinciri (LCC) veya karbin adıyla da bilinir. Karbin üzerinde yapılan deneyler sayesinde, grafen veya karbon nanotüpün iki katı sertliğe, bilinen diğer tüm malzemelerinkini aşan bir özgül güce sahip olduğu, çelikten yaklaşık 200 kat daha güçlü olduğu bilinmektedir. Karbin, nanoteknoloji alanında büyük ilgi çekmektedir.
Lonsdaleit
Lonsdaleit “altıgen elmas” olarak da bilinir. Bilim insanları lonsdaleit adı verilen elmasların yaklaşık 4,5 milyar yıl önce büyük bir asteroid tarafından parçalanan bir cüce gezegenden geldiğini düşünmektedir. Lonsdaleit ilk olarak Arizona’daki Barringer Krateri’nde (Meteor Krateri olarak da bilinir) Canyon Diablo meteoritinden tanımlanmıştır. İlk olarak 1967 yılında keşfedilmiştir. Grafitten elmasa dönüşüm sırasında merkezi bir rol oynadığı düşünülmektedir. Şeffaf kahverengimsi sarı renktedir ve 2,40 ila 2,41 arasında bir kırılma indisine, 3,2 ila 3,3 arasında bir özgül ağırlığa ve 7-8 Mohs sertliğine sahiptir. Elmasın Mohs sertliği 10’dur; lonsdaleitin daha düşük sertliği esas olarak doğal olarak oluşan malzemedeki safsızlıklara ve kusurlara bağlanır. Ayrıca, bir polimer olan poli(hidridokarbyne)’nin argon altında atmosferik basınçta 110 °C’de başlayan termal ayrışması ile de oluşturulabilir.
Lonsdaleit, kübik elmasa rakip olabileceği veya onu aşabileceği düşünülen basınç dayanımı, sertlik ve rijitlik gibi potansiyel olarak üstün mekanik özellikleri nedeniyle de büyük ilgi görmüştür. Bununla birlikte, yoğun çabalara rağmen, lonsdaleit hiçbir zaman ayrı, saf bir malzeme olarak üretilmemiş, bu nedeniyle bu olağanüstü özellikler deneysel olarak kanıtlanamamıştır.
Nanoteknoloji Alanındaki Rolleri
Grafit ve elmas gibi karbon allotropları yüzyıllardır biliniyor olsa da, karbon nanotüpler, grafen ve buckminsterfulleren gibi diğer allotroplar daha yakın zamanda keşfedilmiştir. Her yeni karbon allotropunun keşfi, kimyasal kavramlarda devrim yaratmış ve yeni kimya dallarının ortaya çıkmasına neden olmuş, nanoteknoloji alanının gelişiminde önemli roller oynamıştır. Fullerenler, karbon nanotüpler ve grafen gibi sentetik karbon allotropları şu anda nanoelektronik, optoelektronik, hidrojen depolama, sensörler ve eşi benzeri görülmemiş polimer takviyeleri alanlarında yüksek performanslı uygulamalar için muazzam potansiyele sahip en umut verici malzeme ailelerinden birini temsil etmektedir
Amorf Karbonlar
Kristal karbon allotroplarının örneklerinde, tüm moleküllerin tekrarlayan bir temel yapıya sahip olduğu görülmektedir. Bir malzemenin temel yapısı rastgele olduğunda ve düzenli veya tekrarlı olmadığında, bunlara amorf denir. Amorf (şekilsiz) karbon, kristal bir yapıya sahip olmayan, yani moleküler düzeyde uzun menzilli tekrar eden bir modele sahip olmayan, moleküler kusurlara ve düzensizliklere sahip bir karbon allotropudur. Amorf karbon katı bir allotropik karbon şeklidir. Karbonun tüm amorf allotropları opaktır, yani ışığın içlerinden geçmesine izin vermezler. Amorf karbonun bazı örnekleri odun kömürü (mangal kömürü), kömür, lamba isi, gaz karbon (karni kömürü), kurum ve kok kömürüdür. Bu amorf karbonlar genellikle kristal karbonlardan çok daha fazla safsızlıkla (karbon dışındaki elementlerin varlığı) oluşturulmaktadır. Tekstil, plastik, gıda paketleme, sağlık sektörü, gaz ve su filtreleme ile elektrik uygulamaları gibi diğer bazı alanlarda uygulama bulurlar. Amorf karbonun bazı türleri ve özellikleri aşağıdadır.
Kömür
Siyah veya siyaha yakın katı yanıcı maddedir. Yakıt olarak kullanılır. Doğal olarak, yüksek basınç ve sıcaklıkta nem varlığında ahşap veya bitkisel maddenin kısmen ayrışmasıyla oluşur.
Kok
Kömürün yıkıcı damıtılmasından sonra elde edilen kalıntıdır. Bu işlem sırasında uçucu organik maddeler dışarı çıkar. Dumansız yandığı için yakıt olarak kullanılan saf karbon şeklidir. Metalurjide indirgeyici ajan olarak da kullanılır.
Odun kömürü
Odun ya da mangal kömürü, koyu renkli, katı bir karbon şeklidir. Odun, şeker, kemik vb. organik maddelerin yıkıcı damıtılmasıyla üretilir. Organik maddeler sınırlı hava kaynağında güçlü bir şekilde ısıtılır. Yakıt olarak kullanılan bu kömürler oldukça gözeneklidir, zehirli gazları emmek ve sıvıları arıtmak için adsorban olarak da kullanılır.
Gaz karbon
Gaz karbon, kömür gazı üretimi sırasında gaz imbiğinin iç kısmında biriken karbonun yoğun şeklidir. İyi bir elektrik iletkenidir ve kuru hücrede elektrot yapmak için kullanılır.
Lamba isi
Lamba isi ya da lamba siyahı (karbon siyahı olarak da bilinir), doğal gaz ve diğer karbon açısından zengin bileşiklerin sınırlı hava kaynağında yakılmasıyla elde edilen, ince ayrılmış siyah toz halinde bir kurumdur. Mürekkep, siyah boya, ayakkabı cilası, karbon kağıdı vb. imalatında kullanılır.
Kaynakça:
https://www.studysmarter.co.uk/explanations/chemistry/physical-chemistry/allotropes-of-carbon/
https://www.coursehero.com/study-guides/introchem/allotropes-of-carbon/
https://sciencequery.com/allotropes-of-carbon/
https://unacademy.com/content/neet-ug/study-material/chemistry/the-allotropic-forms-of-carbon/
https://www.chemguide.co.uk/atoms/structures/giantcov.html
https://www.tulomsas.com.tr/karbon-allotroplari-nelerdir-4-karbon-allotropu/
https://webders.net/813/karbonun-allotroplari.html
https://www.products.pcc.eu/tr/blog/karbonun-allotropik-cesitleri-nelerdir/
Yazar: Müşerref ÖZDAŞ
