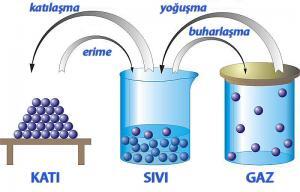
 Maddelerin bütünsel yapılarını koruyan, moleküllerini oluşturan atomların arasındaki çekim kuvvetidir. Bu kuvvetin (kimyasal bağın) ortadan kaldırılması için kimyasal işlem uygulanması gerekir. Maddelerin atomlarının oluşturduğu moleküllerin arasındaki çekim kuvveti ise daha zayıftır. Maddelerin katı, sıvı, gaz gibi farklı fiziksel hallerde olabilmelerinin nedeni, bu çekim kuvvetinin farklı büyüklüklerde olmasıdır. (Bu yazıda, maddenin “plazma” hali, ve hal atlayarak ani değişimi ifade eden süblimleşme ve kırağılaşma ele alınmamıştır.)
Maddelerin bütünsel yapılarını koruyan, moleküllerini oluşturan atomların arasındaki çekim kuvvetidir. Bu kuvvetin (kimyasal bağın) ortadan kaldırılması için kimyasal işlem uygulanması gerekir. Maddelerin atomlarının oluşturduğu moleküllerin arasındaki çekim kuvveti ise daha zayıftır. Maddelerin katı, sıvı, gaz gibi farklı fiziksel hallerde olabilmelerinin nedeni, bu çekim kuvvetinin farklı büyüklüklerde olmasıdır. (Bu yazıda, maddenin “plazma” hali, ve hal atlayarak ani değişimi ifade eden süblimleşme ve kırağılaşma ele alınmamıştır.)
Maddenin Hal Değiştirmesi
Herhangi bir maddenin molekülleri arasındaki mesafenin büyüklüğü molekülleri arasındaki çekim kuvvetinin büyüklüğünü etkiler. Bir maddenin moleküllerinin aralarındaki açıklığın artması bu çekim kuvvetini zayıflatır. Tanecikleri birbirlerine çok yakın olan, dolayısıyla katı halde bulunan bir maddenin tanecikleri arasındaki çekim kuvveti de çok yüksektir.
Isıtılan bir katı maddenin düzensizliği artar yani taneciklerinin hareket enerjisi artar ve tanecikler birbirlerinden uzaklaşmaya başlarlar. Taneciklerin aralarındaki çekim kuvveti zayıflar ve katı haldeki madde hal değiştirerek sıvı hale geçmiş olur. Eğer sıvılaşan madde ısıtılmaya devam edilirse, taneciklerinin hareketi de artarak birbirlerinden uzaklaşmaya devam ederler. Böylece, taneciklerinin çekim kuvveti yok denecek kadar zayıflamış olan sıvı haldeki madde yeniden hal değiştirip, gaz haline geçer.
Moleküller Arasındaki Bağların Kopması
Katı haldeki maddelerin moleküllerinin arasındaki boşluklar sıvı ve gaz halindeki maddelere göre çok daha azdır. Bu nedenle de, katı maddelerin moleküllerinin hareket yeteneği sınırlıdır. Katı maddelerin molekülleri yalnızca “titreşim” hareketi, sıvı maddeler ve gazlar hem “titreşim” hem “öteleme” hareketi yaparlar. Maddenin sıcaklığı arttıkça, ısı enerjisi ve parçacıklarının titreşimi artar ve giderek “erime” ve “buharlaşma” olayları gerçekleşir:
– Erime:
Isı enerjisi ve parçacıklarının hareketi artan katı haldeki maddenin molekülleri arasındaki bağlar zayıflayarak kısmen kopar, atomları daha serbest hareket eder ve madde eriyerek sıvı hale geçer.
– Buharlaşma:
Sıvı haldeki madde ısı almaya devam ederse, moleküller arasındaki bağlar tamamen kopar, tanecikler çok hızlı hareket etmeye başlar ve bir arada duramaz. Maddenin gaz haline geçmesiyle buharlaşma olayı gerçekleşir.
Erime ve buharlaşma sırasında ortamdan ısı alındığından ortamın sıcaklığı da düşer. Günlük hayatta, buharlaşmanın bu özelliği soğutma amaçlı kullanılmaktadır.
Moleküller Arasındaki Bağların Kurulması
Erime ve buharlaşmanın tersi olan olaylar, yani yoğuşma ve donma olayları gerçekleştiğinde, maddelerin molekülleri arasındaki çekim güçlenerek bağlar yeniden kurulmaya başlar. Parçacıkların hareketleri yavaşlar ve hal değişimi gerçekleşir:
– Yoğuşma:
Gaz halindeki madde ısı kaybettiğinde sıvı hale geçmeye başlar. Hareket enerjisi azalan taneciklerin birbirlerine yaklaştıkça aralarındaki çekim kuvvetinin artması ve moleküllerin arasındaki bağların oluşmasıyla, madde sıvı hale geçmiş olur.
– Donma:
Sıvı haldeki madde ısı kaybettiğinde katı hale geçmeye başlar. Tanecikleri yavaş hareket eder ve aralarında bağlar oluşur. Donan bir maddenin hacminde de bir değişim olur. Donmuş maddelerin hacimleri çoğunlukla küçülürken, bazı maddelerin ve suyun hacmi büyür. Soğuk havalarda su borularında çatlaklar oluşmasının nedeni budur.
Yoğuşma ve donma sırasında ortama ısı verildiğinden ortamın sıcaklığı yükselir.
Erime Ve Donma Isıları
 Her madde ancak belirli bir sıcaklık değerine ulaştığında erimeye başlar ve erime sona erene kadar (saf maddelerde) bu değer sabit kalır. Söz konusu değer termometreyle ölçülebilir ve değişmediği görülebilir. Bir maddenin erimeye başladığı bu sıcaklık değerine “erime ısısı” ya da “erime noktası” denir. Öz ısı gibi, erime ısısı da, maddelerin ayırt edilmesine yarayan bir özelliktir ve “Le” ile gösterilir. Erime ısısı birimi Joule / gram (J / g) ya da Kalori / gram (Cal / g) dır. Örneğin, kurşunun erime ısısı 24,5 J / g, gümüşün 88,2 J / g, altının 64,4 J / g, bakırın erime ısısı ise 134 J / g’dır. Erime noktasındaki bir maddenin tamamının erimesi için gerekli olan ısı
Her madde ancak belirli bir sıcaklık değerine ulaştığında erimeye başlar ve erime sona erene kadar (saf maddelerde) bu değer sabit kalır. Söz konusu değer termometreyle ölçülebilir ve değişmediği görülebilir. Bir maddenin erimeye başladığı bu sıcaklık değerine “erime ısısı” ya da “erime noktası” denir. Öz ısı gibi, erime ısısı da, maddelerin ayırt edilmesine yarayan bir özelliktir ve “Le” ile gösterilir. Erime ısısı birimi Joule / gram (J / g) ya da Kalori / gram (Cal / g) dır. Örneğin, kurşunun erime ısısı 24,5 J / g, gümüşün 88,2 J / g, altının 64,4 J / g, bakırın erime ısısı ise 134 J / g’dır. Erime noktasındaki bir maddenin tamamının erimesi için gerekli olan ısı
Q (ısı) = m (kütle) . Le (erime ısısı)
bağıntısıyla hesaplanır.
Her sıvı madde ancak belirli bir değerde ısı kaybettiğinde donmaya başlar. Sıvı halden katı hale geçmesi için dışarıya vermesi gereken ısıya, “donma ısısı” denir. Donma ısısı da, erime ısısı gibi, ayırt edici bir özelliktir. Bir maddenin donma ısısı ile erime ısısı birbirine eşittir. Donma ısısı “Ld” ile gösterilir. Donma sıcaklığındaki bir maddenin tamamen donması için vermesi gereken ısı
Q = m . Ld (donma ısısı)
bağıntısıyla hesaplanır.
Maddelerin, donma sırasında ortama ısı verme özelliğinden günlük hayatta da yararlanılır. Örneğin, meyve ve sebze depolarına su konularak donmaları önlenmiş olur. Ayrıca, saf bir sıvı maddede bir katı madde çözündürüldüğünde o sıvının donma ısısı değişir ve azalır. Örneğin, tuz suyun donma noktasını düşürdüğünden, kış aylarında yollara tuz serpilerek buzlanma önlenir.
Yoğuşma Ve Buharlaşma Isıları
 Gaz halindeki bir maddenin 1 gramının yoğuşması için ortama vermesi gereken ısı “yoğuşma ısısı” olarak adlandırılır. Bir maddenin yoğuşma ısısıyla buharlaşma ısısı birbirine eşittir.
Gaz halindeki bir maddenin 1 gramının yoğuşması için ortama vermesi gereken ısı “yoğuşma ısısı” olarak adlandırılır. Bir maddenin yoğuşma ısısıyla buharlaşma ısısı birbirine eşittir.
Sıvı halindeki bir maddenin 1 gramının buharlaşması için alması gereken ısıya “buharlaşma ısısı” denir. Maddenin ayırt edici bir özelliğidir ve “Lb” ile gösterilir. Kurşunun buharlaşma ısısı 870 J / g, altının 158 J / g, gümüşün 233 J / g, bakırın buharlaşma ısısı ise 506 J / g’dır. Buharlaşma ısısı belli bir maddenin bir miktarının buharlaşması için gereken ısı
Q = m . Lb
bağıntısıyla hesaplanır.
Buharlaşma için gereken ısı, buharlaşma ısısına ve maddenin kütlesine bağlıdır. Eşit kütleli maddelerde, buharlaşma ısısı ne kadar büyükse, buharlaşma için gereken ısı o kadar büyük olur.
Isınma Ve Soğuma Grafikleri
 Örneğin, buz ısıtıldığında sıcaklığı yükselmeye başlar, bir süre sonra sıcaklığı erime noktasına ulaştığında ise erimeye başlar. Isı verilmeye devam edildiğinde buzun tamamı erir ve sıvı hale geçer. Isıtma hala devam ediyorsa, sıvı bir süre sonra kaynar, son aşamada da buharlaşmaya başlar. Bu süreç içindeki olayların termometreyle ölçülüp kaydedilen sıcaklık değerleri ve maddenin belirli zaman aralıklarındaki değişimleri bir tabloya aktarılıp grafikle gösterilebilir. Bu grafiklere “maddenin ısınma eğrisi” (eğer soğutulmuşsa “soğuma eğrisi”) denir.
Örneğin, buz ısıtıldığında sıcaklığı yükselmeye başlar, bir süre sonra sıcaklığı erime noktasına ulaştığında ise erimeye başlar. Isı verilmeye devam edildiğinde buzun tamamı erir ve sıvı hale geçer. Isıtma hala devam ediyorsa, sıvı bir süre sonra kaynar, son aşamada da buharlaşmaya başlar. Bu süreç içindeki olayların termometreyle ölçülüp kaydedilen sıcaklık değerleri ve maddenin belirli zaman aralıklarındaki değişimleri bir tabloya aktarılıp grafikle gösterilebilir. Bu grafiklere “maddenin ısınma eğrisi” (eğer soğutulmuşsa “soğuma eğrisi”) denir.
Kaynakça:
– David L. Goodstein, “States of Matter”, Dover Books on Physics, Dover Publications.
Yazar: Oben Güney Saraçoğlu
