 Kas kasılması için gerekli enerji ATP’den gelir. Fakat kasta o kadar az miktarda ATP depo edilir ki, bir kaç sarsı bunu hızla tüketir. Neyse ki, kasta bir başka yüksek enerjili fosfat depo edilmektedir.
Kas kasılması için gerekli enerji ATP’den gelir. Fakat kasta o kadar az miktarda ATP depo edilir ki, bir kaç sarsı bunu hızla tüketir. Neyse ki, kasta bir başka yüksek enerjili fosfat depo edilmektedir.
Omurgalılarda ve bazı omurgasızlarda, özellikle derisidikenlilerde, bu bileşik, bir yüksek enerjili fosfat grubunun azotlu organik asit kreatine bağlanmasıyla oluşan kreatin fosfattır. Birçok omurgasız benzer bir bileşik olan arjinin fosfatı kullanır. Bu iki bileşik (kreatin fosfat ve arjinin fosfat) fosfagenler olarak adlandırılır. Fosfagenler, kasın kasılma mekanizması için doğrudan enerji sağlayamazlar; fakat yüksek enerjili fosfat gruplarını ADP’ye vererek ATP oluşmasını sağlarlar ve ATP de kasılma için doğrudan enerji kaynağı oluşturur. Kasta, glikoliz mekanizması ve hücre solunumu hızlanana kadar geçen birkaç saniyelik zamanda güçlü bir kasılmaya yetecek kadar yüksek enerjili fosfat depo edilir. Eğer kaslar fazla kullanılmıyorsa, fosfagen ve ATP deposunu yenilemek için kullanılan enerjinin çoğu besinlerin tamamen karbondioksit ve suya oksidasyonundan gelir. Solunum ve dolaşım sistemleri uyum gösterip aktif kaslara gönderilen oksijen miktarı aktarılana kadar geçen sürede kırmızı kaslarda oksidatif fosforilasyon için gerekli oksijenin bir kısmı oksijelenmiş miyoglobinden sağlanır. Miyoglobin, kas hücrelerine özgü özel bir oksijen depolayıcı proteindir ve bol miktarda O2 varken onunla zayıf bağ yapıp gereksinim artana kadar depolar.
Yoğun egzersiz ya da ağır bir cismin kaldırılması gibi aşırı kas aktivitesi sırasında kasların (özellikle beyaz kasların) enerji gereksinmesi, hiç yardım almadan sadece solunum tarafından karşılanamayacak kadar büyük olur; çünkü dokulara yeterli oksijen gereken hızda ulaştırılamaz. Bu koşullarda laktik asit fermentasyonu meydana gelir.
Kaslar fazladan gereksinim duydukları enerjiyi sadece anaerobik yol olan glikolizden elde ederler ve fizyologların oksijen açık dediği olayı meydana getirirler. Laktik asitin bir kısmı kasta depo edilir; fakat çoğu kan yoluyla hızla karaciğere taşınır. Aşırı aktivite sona erdikten sonra, güçlü ve hızlı nefes alma periyodu başlar. Bu yolla karaciğere bol O, sağlanır. Böylece karaciğer laktik asiti piruvik asite dönüştürür. Karaciğer piruvik asitin bir kısmını, bu yolla elde edilen enerjiyi kullanarak okside eder ve laktik asitin geri kalanından yeniden glikojen sentezler. Bu yolla oksijen açığı kapatılmış olur. 
Eğer ATP kas kasılması için acil enerji kaynağı ise, ATP kasılma işlemine nasıl katılıyor ve bu işlem nedir? Kasın analizi göstermiştir ki, kasılabilir kısımlarının en büyük bileşenleri iki protein, aktin ve miyozindir. Miyozin ATP’yi bir konformasyon değişikliği için kullanıyor ve bu değişiklik de hareketi doğuruyor. Fakat kas içinde miyozin başka bir formda bulunur ve her iki protein düzenli çizgiler halinde yerleşmiştir. Bu yerleşim düzeninin kas hücrelerinin özel kapasitelerini nasıl yarattığına göz atacağız.
İskelet kasının özelliğinin açık ve koyu bantların oluşturduğu çizgiler olduğunu ve bunun bağ dokuyla bir arada tutulan çok sayıdaki kas tellerinden (hücrelerinden) oluştuğunu görmüştük. Daha yüksek büyütmeler, bu tellerin, 1-2 in çapında olan ve aralarındaki sitoplazmada mitokondrilerin yerleşmiş olduğu çok sayıda ince miyofibrille dolu olduğunu açığa çıkarmıştır. Miyofibriller de bir parçası oldukları kasla aynı çizgili yapıyı gösterirler. Oldukça geniş açık bantlarla koyu bantlar sırayla yerleşmişlerdir. Açık bantlara I bantları , koyulara A bantları denir. Her bir koyu A bandının ortasında, A bandının geri kalan kısmından daha açık; fakat I bantlarından daha koyu bir bölge vardır ki buna H tonu adı verilir. Açık I bandının ortasında bulunan çok koyu çizgiye Z bandı denir. Bir Z bandından diğerine uzanan bölgenin tümüne sarkomer adı verilir. Sarkoınerler kas kasılmasının işlevsel birimleridir.
İskelet kasının bu kadar tipik olan çizgileri işlevsel kasılabilir birimlerin yapısal bir yansıması olabilir mi? Çeşitli bulgulara göre, evet. Kimyasal analizler göstermiştir ki, miyozin A bantlarında, aktin ise I bantlarında yoğunlamıştır. Bunun da ötesinde, Cambridge Üniversitesinden A. F. Huxley, 1954’de, teller kasılınca bantların oransal genişliklerinin değiştiğini göstermiştir: I bantları ve H zonları daralmakta; fakat A bantları çok az değişmektedir. Sonuçta A bantları birbirine yaklaşmaktadır.
A. F. Huxley’in yüksek güçteki bir ışık mikroskobu altında deneylerini yürütmekte olduğu sıralarda, o zamanlar Londra’daki University College’de H. E. Huxley (aralarında akrabalık yoktur), kası elektron mikroskopla incelemeye başladı ve her miyofibrilde iki tip flament olduğunu buldu. Kalın ve ince olan bu filamentler çok ince bir düzende yerleşmişlerdi. Bu ikisi, kalın olanlar sadece A bantlarında ve inceler esas olarak I bantlarında; fakat A bantlarına bir miktar uzanmış biçimde yerleşmişlerdir. Bu dağılım A bantlarının I bantlarının ve H zonlarının farklı görünümlerini açıklar. Her koyu A bandı tam olarak bir kalın filament bölgesi uzunluğundadır; kalın ve ince filamentlerin üst üste geldikleri uç bölgeleri daha koyu, sadece kalın filamentlerin bulunduğu orta bölgesi ya da H zonu daha açıktır. Her I bandı, sadece ince filamentlerin bulunduğu bir bölgeye karşılık gelir. Z çizgisi, ince filamentlerin, tam ortalarından tutundukları bir yapıdır ve kasılma sırasında ince fila mentler çekme gücünü bu yapıya uygularlar. Bu bantın bir işlevi de filamentleri düzgün sırada tutmaktır. Aktin filamentlerini Z bandına tutturan protein alfa aktini adını alır. Desmin olarak bilinen bir diğer protein de aktini düzgün konumda tutar.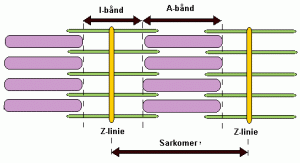
Her iki Huxley de, yaptıkları gözlemler sonucu ve birbirlerinden bağımsız olarak yeni bir kas kasılması teorisi önerdiler. Buna göre, filamentler katlanmak yerine, birbirleri üzerinde kayarak iç içe giriyorlardı.
Eğer filamentler birlikte kayarlarsa, kalın ve ince filamentlerin üst üste bindiği bölge, bir A bandının iki ucundaki I bantlarındaki ince filamentler birbirine değinceye ve hafifce üst üste bininceye kadar, genişleyecektir. Bu kayma, H zonunun genişliğini azaltacak ve eğer ince filamentler birbirine değerse bu zon tamamen yok olacaktır. Birlikte kayma, aynı zamanda Z çizgilerini de birbirine yaklaştıracak ve I bantlarının genişliğini büyük ölçüde azaltacaktır. Fakat A bantlarının genişliği çok az değişecektir; zira bu bantlar kalın filamentlerin boyuna karşılık gelir ve bu da değişmez (belki aşırı kasılma durumunda Z çizgileriyle temas etme sonucunda biraz büzülme dışında). Böylece, kayma teorisi sarkomerlerde gözlenen değişiklikleri açıklamaktadır. Fakat kaymanın nasıl meydana geldiği keşfedilmeyi beklemektedir.
Kalın filamentler miyozinden, ince filamentler de esas olarak aktinden oluşurlar. Kalın miyozin filamentleriyle ince aktin filamentleri arasında bir çeşit bağlantı bulunmalıdır ve elektron mikroskop fotoğrafları, bunların arasında küçük çapraz köprülerin varlığını gösterir. Bulgular, bunların kalın filamentlerin kısımları olduğunu kanıtlar. Tek bir kalın fılament, miyozin moleküllerinden oluşan bir demet gibidir. Bu moleküllerden her biri ise uzun bir kuyruk kısmı ve bir çift globular baştan oluşur. Bir miyozin molekülü proteolitik enzimlerle kısımlarına ayrılırsa aktine bağlanan ve ATP’yi hidroliz edenin baş bölgelerin miyozin olduğu görülür. Bu da bunların çapraz köprüler olduğuna ilişkin güçlü bir belirtidir.
Huxley’in kayan filament teorisine göre, çapraz köprüler, miyozin filamentlerinin aktin filamentlerini çekmesine olanak sağlayan kancalar ya da kaldıraçlar gibi çalışırlar. Çapraz köprüler aktine doğru bükülürler ve özelleşmiş reseptör bölgelerinde ona bağlanırlar. Daha sonra diğer yönde bükülürler ve bu sırada aktini de çekerler. Bundan sonra aktini bırakırlar, ilk büküldükleri yöne yeniden bükülürler, yeni bir aktif bölgede aktine bağlanırlar ve onu tekrar çekerler. Başka bir ifadeyle, filamentlerin bir kayma hareketi tek yönlü bir çark mekanizmasıyla gerçekleştirilir. Gerekli enerji, ATP’nin miyozin tarafından hidroliz edilmesiyle sağlanır. Her ne kadar düz kas hücrelerinde, çizgili kas hücrelerindeki filament düzeni yoksa da, bulgular bu hücrelerin de esas olarak aynı mekanizmayla kasıldıklarını göstermektedir.
Kaynakça:
https://www.sciencedirect.com
Yazar: Taner Tunç
